Das Gesetz von Boyle und Mariotte
Im Alltag sehen wir das bei der Fahrradpumpe. Wenn wir vorne das Ventil mit dem Finger zuhalten und den Kolben niederdrücken, verringert sich in der Pumpe das Volumen und der Druck steigt.
Das hat natürlich auch große Auswirkungen auf das Tauchen. Wenn wir einen mit Luft gefüllten Ballon ins Wasser mitnehmen und abtauchen, sehen wir, dass der Ballon kleiner wird. Blasen wir umgekehrt einen Ballon in der Tiefe etwas auf, dann wird er beim Auftauchen größer, eventuell platzt er auch. Erklärt wird uns dies im Gesetz von Boyle und MarriotteDieses Gesetz beschreibt den Sachverhalt, dass in einem abgeschlossenen Behälter das Volumen sich proportional zum Druck ändert, sofern die Temperatur gleich bleibt. Das Verhältnis von Volumen zu Druck ist also konstant:
p · V = k
Wir können also auch zwei unterschiedliche Drücke und Volumina miteinander vergleichen:
p1 · V1 = p2 · V2
Damit kann man z.B. das Volumen eines gasgefüllten Gegenstands auf unterschiedlichen Tiefen ausrechnen, wenn man das Anfangsvolumen und die Drücke weiß:
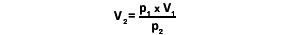
Beispiel:
Wir blasen in 25m Tiefe in einen Hebesack 1,5l Luft . Wie groß ist das Volumen auf 12m Tiefe? Die Anfangstiefe von 25m entspricht 3,5 bar, die Endtiefe auf 12m entspricht 2,2 bar. Damit gilt:
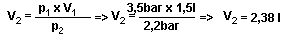
Das Volumen des Hebesacks beträgt auf 12m Tiefe 2,38l.
Druckänderung beim Abtauchen
Beim Abtauchen spielt das Gesetz von Boyle-Mariotte auch eine wichtige Rolle in Bezug auf unseren Abtrieb. Wenn wir abtauchen, reduziert sich das Volumen unseres Jackets und das des Neoprenanzugs. Durch die Volumenreduktion erhalten wir aber mehr Abtrieb, so dass wir schneller sinken. Um also eine kontrollierte Sinkgeschwindigkeit zu erhalten oder uns auf einer bestimmten Höhe auszutarieren, müssen wir durch Zugabe von Luft das Volumen des Jackets wieder erhöhen.
Druckänderung beim Auftauchen
Ganz besonders wichtig ist es aber, daran zu denken, dass auch bei flexiblen Körpern die Ausdehnung begrenzt ist. Wird die maximal mögliche Ausdehnung überschritten, kann dieser Körper platzen. Haben wir z.B. ein Jacket mit einem Volumen von 15l und pumpen es auf 20m auf 10l, hätte es auf 10m sein maximales Volumen erreicht (Volumenzunahme zwischen 20 und 10m entspricht 50% also in diesem Fall 5l). Steigen wir weiter, bestünde die Gefahr, dass das Jacket platzt. Damit dem nicht so ist, haben Jackets Überdruckventile eingebaut, damit der Druck entweichen kann. Da das Volumen proportional zunimmt, nimmt entsprechend der Auftrieb proportional zu, d.h. man würde in so einem Fall auch immer schneller steigen. Um nicht unkontrolliert aufzuschießen, müssen wir daher aus unserem Jacket beim Austauchen immer entsprechend Luft ablassen.
Unsere Lunge hat leider keine Überdruckventile. Wenn man davon ausgeht, dass eine Durchschnittslunge eine Totalkapazität von ungefähr 6l hat, kann man sich vorstellen was passieren würde, wenn man auf 10m mit 4l Luft in der Lunge zur Oberfläche steigen und dabei die Luft anhalten würde. Nach unserer Formel wäre die Totalkapazität erreicht bei:
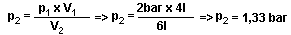
1,33 bar haben wir auf einer Wassertiefe von 3,3m. Da die Lunge sehr empfindlich ist und nur einen ganz geringen Überdruck tolerieren kann, besteht bei weiterem Auftauchen mit angehaltenem Atem die Gefahr eines Lungenrisses! Deswegen ist es lebenswichtig, beim Auftauchen immer kontinuierlich (aus-) zu atmen!
Dalton - Gesamtdruck und Einzeldrücke
Bisher haben wir immer von Gasen geredet, aber das was sich in unseren Flaschen befindet ist kein reines Gas, sondern ein Gasgemisch. Die Luft die wir atmen besteht zu 78% aus Stickstoff, 21% Sauerstoff und zu 1% aus anderen Gasen. Teilweise ist es aber wichtig für uns zu wissen, welcher Druck eines dieser Gase innerhalb des Gemisches hat.
Der Druck eines Gasgemisches errechnet sich aus der Addition der Drücke seiner Teilgase (Partialdruck). Die einzelnen Partialdrücke ergeben also den Gesamtdruck.
Beispiel:
Luft mit einem Druck von einem Bar. Wir wissen, dass Luft aus Stickstoff, Sauertsoff und anderen Gasen besteht. Durch Daltons Gesetz können wir deshalb errechnen, dass der Partialdruck von Stickstoff (ppN) 0,78 bar entspricht, der von Sauerstoff (ppO2) 0,21 bar und die anderen Gase einen Partialdruck von 0,01 bar haben. Dies geschieht mit folgender Formel:
Teildruck= Gesamtdruck · Volumenprozent/100
Am Beispiel Stickstoff auf Meereshöhe: 1bar · 78/100 = 0,78 bar
Wie sieht es jetzt in 10m Tiefe aus? Die Luft die wir in dieser Tiefe atmen besteht natürlich immer noch aus 78% Stickstoff, 21% Sauerstoff und zu 1% aus anderen Gasen. Durch die 100%ige Druckerhöhung auf 2 Bar erhöhen sich allerdings auch entsprechend die Teildrücke:
Stickstoff: 2bar · 78/100 = 1,56 bar
Sauerstoff: 2bar · 21/100 = 0,42 bar
Sonstige Gase: 2bar · 1/100 = 0,02 bar
Ebenso einfach können wir auch den Partialdruck von Stickstoff auf 20m (entspricht 3 Bar) ausrechnen:
3bar · 78/100 = 2,34 bar
78% von 3 bar entspricht also einem ppN von 2,34 bar. Entsprechend beträgt der ppO2 auf
20m 0,63 bar.
Die Teildrücke der einzelnen Gase wirken sich auf unseren Organismus aus. So besteht bei einem ppO2 Druck von 1,6 bar die Gefahr der Sauerstoff-Toxizität, d.h. der Sauerstoff wirkt sich
auf unseren Körper giftig aus. Mit Hilfe des Gesetzes von Dalton können wir die Tiefe ausrechnen:
X bar · 21/100 = 1,6 bar
also: X bar = 1,6 bar/0,21 = 7,6 bar
7,6 bar entspricht einer Tiefe von 66m
Damit wissen wir, dass ab einer Tiefe von 66m die Gefahr besteht, dass Sauerstoff in unserem Körper giftig wird, was sich z.B. durch plötzliche Krämpfe zeigt. Damit haben wir (abgesehen von der Gefahr eines Tiefenrausches) eine maximale Tiefe für Tauchgänge mit Luft.
Das Gesetz von Henry
Wenn wir eine neue Sprudelflasche öffnen, zischt es und aus der Flüssigkeit perlt Kohlensäure aus. Woher kommt dieses Gas auf einmal und warum perlt es jetzt aus? Der Grund, warum wir im Sommer erfrischende Sprudel trinken können, liegt in der Löslichkeit von Gasen in Flüssigkeit.
Die Menge eines in Flüssigkeit gelösten Gases ist abhängig von der Temperatur und dem Druck über der Flüssigkeit.
Gase lösen sich in Flüssigkeiten. Flüssigkeiten können abhängig vom Druck eine bestimmte Anzahl Moleküle einlagern. Ist diese Grenze erreicht, spricht man davon, dass eine Flüssigkeit gesättigt ist. Erhöht man den Gasdruck, werden so lange mehr Moleküle in die Flüssigkeit eindringen als austreten, bis der Sättigungszustand für diesen Druck erreicht ist. Senkt man den Gasdruck, werden so lange mehr Moleküle aus der Flüssigkeit austreten als eindringen, bis der Sättigungszustand für diesen Druck erreicht ist. Die Zeitdauer, bis dieses Gleichgewicht erreicht ist hängt vom Druckunterschied, der Größe der Oberfläche und dem Löslichkeitskoeffizienten dieses Gases ab.
Auswirkungen für Taucher
Wir nehmen durch die Atmung das Inertgas Stickstoff zu uns und geben es durch die Atmung auch wieder ab. Unser Körper ist an Land mit Stickstoff gesättigt. Gehen wir tauchen lagert sich durch den erhöhten Druck nach Henrys Gesetz entsprechend mehr Stickstoff in unseren Geweben ein. Sowohl Auf- wie auch Entsättigung geschehen über die Atmung und den Blutkreislauf. Beim Auftauchen müssen wir deshalb den Druck entsprechend langsam erhöhen, um eine sprunghafte Entsättigung mit Blasenbildung zu vermeiden.
kopiert von http://www.tauchtheorie.nowotaucher.de